我國已建立適應全球同步臨床研究的監管框架,但從全球角度來看,目前我國臨床研究仍然存在著一些尚未妥善解決的問題,如合格的臨床試驗機構較少,醫藥生產企業申辦方的選擇余地小,不能滿足新藥研發上市的需求,從而影響健康中國2025規劃。
全國取得醫療器械臨床試驗機構資質的醫療機構僅有998家左右,取得藥物臨床試驗機構備案資質的有1073家,略多與醫療器械,但2020年全國醫療機構總數 1006931家,占全部醫院總數的比例不足1%。隨著我國在醫藥創新領域取得明顯突破,臨床研究資源的短缺問題日益凸顯。并不是所有醫療機構又能成為備案機構,篩選的門檻必須是二級甲等以上醫療機構。
我們推出臨床試驗機構備案服務,旨在通過外派專業人才梳理完善臨床試驗SOP文件、操作風險定級、倫理及機構體系文件建立、項目質控、培訓醫療器械相關法規、傳遞最新法規動態等協助醫療機構完成備案,并在后期為機構項目操作與管理提供全程的咨詢服務。我們現已整合形成了一套完善的機構備案體系文件和輔導機制。
機構備案對醫院的意義
開展藥物和醫療器械臨床試驗不僅可以支持國家醫藥事業的發展、振興民族醫藥工業、保障人民健康, 且對醫療機構自身的發展和建設起到積極作用。
1、有利于醫院樹立品牌權威。提高公眾對醫院的評價,建立醫院在老百姓心中的威信,提升醫院的知名度和影響力,進一步實現社會效益和經濟效益兼顧。
2、有利于醫院開展循證醫學研究。循證醫學:是指臨床醫生對患者的診治都應該有充分的科學依據,任何決策都需建立在科學證據的基礎上,而這種科學也是當前最佳證據。近年來,醫患關系日趨緊張,采用循證醫學的原理和方法來規范醫療服務行為已越來越為人們的共識。
3、有利于提升醫院的科研水平。開展臨床試驗本身就是一項科學研究,開展臨床試驗為醫療機構提供很好的科研平臺,有利于機構多出成果,多出論文。臨床試驗至少會在兩家以上的機構進行試驗,有利于加強醫療機構與同行的合作、增加學術交流的機會,取人之長,補己之短,從而提高醫療機構的科研學術水平。
4、有利于醫護人員SCI論文的撰寫與發表。論文發表是學術成就的一種體現,可以提高自己的知名度,給同行提供學術性的價值參考,并有助于醫護人員評職稱和晉升。
5、有利于規范醫院的倫理工作。隨著國家涉及倫理的臨床工作及科學研究的審查越來越嚴格,以及患者醫療知識、法律意識的提高 ,倫理問題越來越突顯。通過臨床試驗機構的備案,更規范醫院的倫理工作。
6、有利于促進醫護人員合理用藥。醫務人員參加一項臨床時,對該藥的療效、安全性、用法、療程及用藥的適應癥、禁忌癥等有較全面的了解,必然能夠更好地運用到患者身上,有利于規避醫療風險。
7、有利于增強醫務人員“以患者為中心”的服務理念。臨床試驗要求受試者入組前必須將試驗的詳細情況 告知受試者,并簽署知情同意書,試驗過程中如發生不良事件,研究者應該采取治療措施并及及時報告,整個過程要為受試者保密,整個過程都要求研究者處處為患者的利益著想。充分尊重患者的權利。增加了以患者為中心的服務理念,緩解了醫患關系緊張的局面。機構備案后給醫療機構帶來的經濟價值
醫療機構來源于社會,社會是醫療機構的生存環境,市場經濟下,醫療機構的發展壯大和淘汰出局,都與社會有著千絲萬縷的關系。醫療器械單個臨床試驗費用都在上百萬,藥物單個臨床試驗費用更是數百萬、上千萬不止。以鄭州大學xxxx醫院為例,2020年臨床試驗機構帶來收入上億元;福建xxxxxx醫院,2020年臨床試驗機構帶來收入2000萬以上,由此成為全國醫療機構科研創收前300名;鶴壁xx醫院,2020年臨床試驗機構帶來收入1000萬以上......臨床機構備案推動醫藥事業蓬勃發展的同時也為醫院帶來巨大的經濟價值。藥物臨床試驗機構應當具備的基本條件
(一)具有醫療機構執業許可證,具有二級甲等以上資質,試驗場地應當符合所在區域衛生健康主管部門對院區(場地)管理規定。開展以患者為受試者的藥物臨床試驗的專業應當與醫療機構執業許可的診療科目相一致。開展健康受試者的Ⅰ期藥物臨床試驗、生物等效性試驗應當為Ⅰ期臨床試驗研究室專業;
(二)具有與開展藥物臨床試驗相適應的診療技術能力;
(三)具有與藥物臨床試驗相適應的獨立的工作場所、獨立的臨床試驗用藥房、獨立的資料室,以及必要的設備設施;
(四)具有掌握藥物臨床試驗技術與相關法規,能承擔藥物臨床試驗的研究人員;其中主要研究者應當具有高級職稱并參加過3個以上藥物臨床試驗;
(五)開展藥物臨床試驗的專業具有與承擔藥物臨床試驗相適應的床位數、門急診量;
(六)具有急危重病癥搶救的設施設備、人員與處置能力;
(七)具有承擔藥物臨床試驗組織管理的專門部門;
(八)具有與開展藥物臨床試驗相適應的醫技科室,委托醫學檢測的承擔機構應當具備相應資質;
(九)具有負責藥物臨床試驗倫理審查的倫理委員會;
(十)具有藥物臨床試驗管理制度和標準操作規程;
(十一)具有防范和處理藥物臨床試驗中突發事件的管理機制與措施;
(十二)衛生健康主管部門規定的醫務人員管理、財務管理等其他條件。
藥物臨床試驗機構為疾病預防控制機構的,應當為省級以上疾病預防控制機構,不要求本條前款第一項、第五項、第六項條件。醫療器械臨床試驗機構應當具備的基本條件
(一)具有醫療機構執業資格;
(二)具有二級甲等以上資質;
(三)承擔需進行臨床試驗審批的第三類醫療器械臨床試驗的,應為三級甲等醫療機構;
(四)具有醫療器械臨床試驗管理部門,配備適宜的管理人員、辦公條件,并具有對醫療器械臨床試驗的組織管理和質量控制能力;
(五)具有符合醫療器械臨床試驗質量管理規范要求的倫理委員會;
(六)具有醫療器械臨床試驗管理制度和標準操作規程;
(七)具有與開展相關醫療器械臨床試驗相適應的診療科目,且應與醫療機構執業許可診療科目一致;
(八)具有能夠承擔醫療器械臨床試驗的人員,醫療器械臨床試驗主要研究者應當具有高級職稱,其中開展創新醫療器械產品或需進行臨床試驗審批的第三類醫療器械產品臨床試驗的主要研究者應參加過3個以上醫療器械或藥物臨床試驗;
(九)已開展相關醫療業務,能夠滿足醫療器械臨床試驗所需的受試人群要求等;
(十)具有防范和處理醫療器械臨床試驗中突發事件和嚴重不良事件的應急機制和處置能力;
(十一)國家食品藥品監督管理總局、國家衛生和計劃生育委員會規定的其他條件。
其他承擔體外診斷試劑臨床試驗的血液中心和中心血站、設區的市級以上疾病預防控制機構、戒毒中心等非醫療機構開展按醫療器械管理的體外診斷試劑臨床試驗,其應當具備以下條件:
(一)具有相應業務主管部門發放的機構資質證明文件;
(二)具有體外診斷試劑臨床試驗的管理部門,配備相應人員、辦公條件,并具有對體外診斷試劑臨床試驗的組織管理和質量控制能力;
(三)能夠開展倫理審查工作;
(四)具有體外診斷試劑臨床試驗管理制度和標準操作規程;
(五)具有與開展體外診斷試劑臨床試驗相適應的診療科目,且應與本機構業務范圍一致;
(六)具有能夠承擔臨床試驗的人員,臨床試驗主要研究者應當具有高級職稱;
(七)已開展相關業務,能夠滿足體外診斷試劑臨床試驗所需的受試人群要求等;
(八)具有防范和處理醫療器械臨床試驗中突發事件和嚴重不良事件的應急機制和處置能力;
(九)國家食品藥品監督管理總局、國家衛生和計劃生育委員會規定的其他條件。臨床試驗機構備案合同

醫療器械臨床試驗機構備案證

道恒臨床試驗機構備案客戶名單
目前正在辦理臨床試驗機構備案和已完成臨床試驗機構備案名單
(保密協議,暫不公開) |
| 鶴壁xx醫院 | 福建xxxxxx醫院 | 天津xxx專科醫院 | 河南xxxx醫院 | 河北xxxx醫院 |
| 長治xx人民醫院 | 新鄉xxxx醫院 | 陜西省xxxx醫院 | 洛陽xxxx醫院 | ...... |
臨床試驗機構備案服務流程
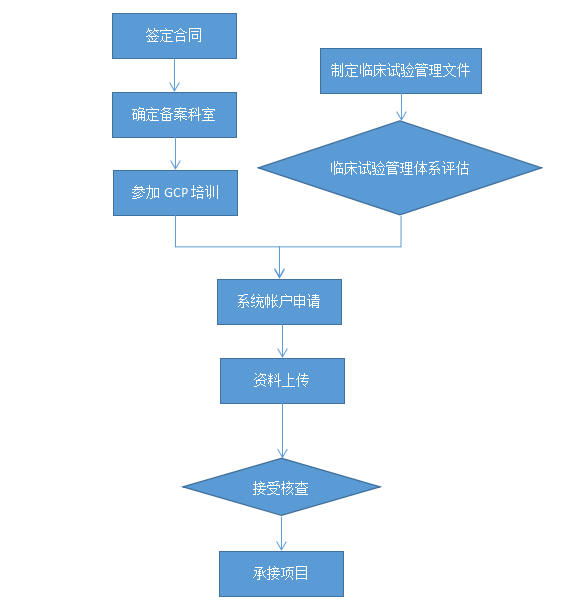
臨床試驗機構備案收費標準
辦理醫療器械/藥物臨床試驗機構備案,官方不收取費用。臨床試驗機構備案辦理依據
| 文件名稱 | 文號 | 發布時間 | 實施時間 |
|---|
| 關于發布醫療器械臨床試驗機構條件和備案管理辦法的公告 | 2017年第145號 | 2017年11月24日 | 2018年1月1日 |
| 國家藥監局 國家衛生健康委關于發布藥物臨床試驗機構管理規定的公告 | 2019年第101號 | 2019年11月29日 | 2019年12月1日 |
臨床試驗機構備案代辦周期
| 分類 | 資料準備時間 | 備案成功時間 |
|---|
| 醫療器械臨床試驗機構備案 | 不超過2個月 | 資料無誤遞交后,
一周內備案成功 |
| 藥物臨床試驗機構備案 | 不超過4個月 | 資料無誤遞交后,
一周內備案成功 |
臨床試驗機構備案相關服務
| 備案相關資料整理 | 備案資料網上遞交 |
| 打點關系壓縮備案周期 | |
道恒對您的風險承諾
1、申辦不成功,全額退款。
由于乙方原因導致申辦不成功,全額退款,可簽署合同條款明確約定。
2、申辦周期2-4個月。
從遞交資料到國家局接受之日算起,到申辦成功周期2-4個月。聯系方式
聯系人:鄧老師 167 1083 8763同微信

郵 箱:sxbeiyi@126.com






